补体调节分子的结构及功
补体系统的激活为一种级联反应,但受到多种调节分子的严格控制,其反应的程度和单一成分的反应都是在生物反馈近代制下而进行的,从而限制了活化的扩大化,以维持补体水平的平衡。调节作用包括两个方面,即自身衷变失活及一些抑制物的灭活作用。前者指已活化的补体分子均不稳定,如不及时与靶细胞膜结合即迅速衰变失活;后者是通过抑制物的作用而使已活化的分子失去活性。这一节中仅涉及后一个方面。
一、C1抑制物
C1抑制物(C1INH)是血清中高度糖基化的一种蛋白质,含糖量高达35-49%。*初由Ranoff和lepow(1957)所发现,称其为C1酯酶抑制剂,与引同时Schultze等则将其称为α2神经氨酸糖蛋白。C1INH为一单链分子,由478个氨基酸残基组成,分子量为104kDa,由478个氨基酸残基组成,分子量为140kDa,链内有两对二硫键(图5-13)。C1INH调节的主要方式是,与活化的C1r或C1s结合形成稳定的复合物而导致C1丝氨酸蛋白酶失活。其作用机理是,C1INH通过提供一个酷似C1r或C1s的正常底物的序列为“锈铒”(“bait”),被c 1r或C1s裂解暴露出一个活性部位,然后再与C1r或C1s结合形成共价的酯键而发挥抑制作用。此外,C1INH还可防止在缺乏抗体时,C1以很低但仍有一定速率出现的自发激活。正常情况下,血液中的大多数C1可被7倍于其克分子浓度的C1INH所结合,以防止C1由于构象改变而引起的自发激活。但C1同抗原、抗体复合物的结合,可使C1从C1INH的抑制作用中而获释。除上述作用外,C1INH还可抑制凝血因子Ⅻa、Ⅺa、激肽释放酶及纤溶酶,因而其在凝血、激肽和纤溶系统中也有重要的调节作用。
经对C1INH cDNA序列的分析发现,C1INH与其它几种丝氨酸蛋白酶抑制物(serpin)超家族成员(α1抗胰蛋白酶、α1抗糜蛋白酶及抗凝血酶Ⅲ等)约有30%的氨基酸同源性,物别是在C端的120个氨基酸。C1INH的编码基因定位于第11号染色体的短臂11.2~长臂13亚区。C1INH先天性缺陷时,可导致遗传性血管神经性水肿(hereditary angioneurotic edema,HAE)。近年报道应用C1INH浓缩剂防治HAE效果良好,但尚未广泛用于临床。
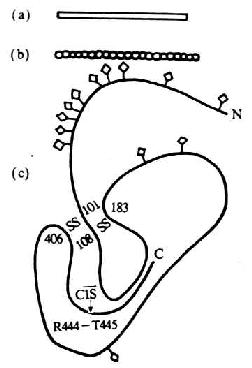
图5-13 C1 INH分子的结构模式图
注:(a)为电镜观察模式图
(b)为中子散射模式图
(c)为园二色谱分析的二级结构模式图
二、C4结合蛋白
C4结合蛋白(C4bp)是一种含量丰富的可溶性血清糖蛋白,分子量为550kDa,1977年由Ferreira等所报道。其分子结构模式现多以Dahlback等(1983)描述的“蜘蛛样”(spiderlike)结构来分析其结构及功能。C4bp由8个亚单位组成,电镜下观察形似蜘蛛,其中有7条分子量相同(均为70kDa)的长链(α链),由549个氨基酸残基组成,链间以二硫键相连结,并共同氨基酸残基组成,链间以二硫键相连结,并共同连结于一中心体。α链含有8个SCR,其N端是其头部,为与C4b相结合的部位,可能位于第332-395位氨基本酸残基。第8条链(β链)较短(45kDa)由235个氨基酸残基组成,含有4个SCR为与蛋白S(PS)相结合的部位(图5-14)。C4bp以两种方式抑制补体的活化。**种方式是,通过其与C2竞争C4b,而从c 4b2a中取代C2a,并通过其与C4b的结合而阴止剩余的C2同C4b结合,由此抑制C3转化酶的形成。C4bp与C4b的结合能力与细胞表面C4b分子的数成正比,且较C2同C4b的结合能力高27倍。**种方式是,C4bp作为I因子的一种辅助因子,促进I因子对C4b的裂解。有C4bp存在时,I因子可将C4b的a`链完全裂解;无C4pb时,I因子的裂解作用不完全。其与I因子结合的活性部位位于第177-322位氨基酸残基区域。PS与C4pb的第8条链(β链)结合,不影响C4bp同C4b的结合,但可延长C4bp的半衷期,从而强化C4bp的抑制作用。
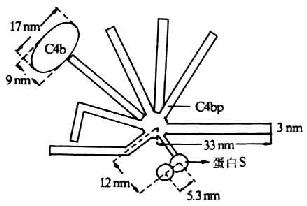
图15-14 C4bp的结构(模式图)
C4bp基因定位于人的第1号染色体长臂32区,同CR1、CR2、H因子、MCP及DAF等的基因相连锁,并均含有数目不同的SCR。
三、促衰变因子(CD55)
促衰变因子(decayaccelerating factor,DAF)是Nicholson-Weller等(1981)用正丁醇提取后,再以层析法从人和豚鼠红细胞基质中纯化的一种膜蛋白。因其具有促进C3转化酶衷变的活性故名。经在还原条件下做SDS-PAGE并以过碘酸-Schiff试剂染色表明,纯化的DAF为单链膜糖蛋白。人和豚鼠的DAF分了量不同分别为70kDa和60kDa。现已按白细胞分化抗原将其归为CD55。Davitz等(1986)通过用磷脂酰肌醇(PI)特异性的磷脂酶C(PI-PLC)处理人外周血细胞可释放DAF的事实探明,DAF是经糖磷脂酰肌醇(glycosylphodphatidylinositol,GPI)锚而固定于细胞膜中的。即糖蛋白的C末端共价结合于含PI的糖磷脂上,再经PI插入细胞膜脂质双层的外层小叶中。研究表明,膜DAF的迁移率接近于膜类脂的迁移率,比大多数膜蛋白迁移率高一个数量级。认为这有助于促进数目有限的膜DAF分子与细胞表面大量的C3b或C4b片段接触。另外DAF的糖磷脂酰肌醇结构还可能具有转导细胞信号的作用。
除Nicholson-Weller等证实的分子量为70kDa的膜DAF外,Kinoshita等(1987)用Western blotting在人红细胞表面还检出分子量为140kDa的一种膜DAF,称其为DAF-2。DAF-2在膜上的数目不足70kDa膜DAF的1/10,但也有促进C3b转化酶衰变的活性,也含有GPI锚结构。由于DAF-2的分子量较70kDa的膜DAF大一倍,提示其为膜DAF的二聚体,但用二巯基乙醇或以SDS使基变性,都不能将DAF-2裂解成两个成分,故DAF-2的**结构仍有待进一步阐明。另外,近年应用两位点RIA测定法,在血浆、尿液、泪液、唾液、滑膜液和脑脊液,以及组织培养上清中均检出可溶性的DAF(sDAF),水平的40-400ng/ml范围。并发现尿液中的sDAF分子量略低于红细胞上膜DAF的分子量,疏水性也较膜DAF小,其抑制细胞表面C3转化酶内在装配的活性较膜DAF约低100倍,但仍具有促进已形成的C3转化酶衰变的作用,效能类似于C4bp。
膜DAF广泛分布于各种血细胞及其他各处的细胞上,包括红细胞、粒细胞、单核细胞、**细胞(T、B)、血小板、骨髓单个核细胞、红细胞的始祖细胞,角膜、结合膜、消化道粘膜、外分泌腺、肾小管、膀胱、**粘膜、胞膜、心包及滑膜的上皮细胞,精子,以及培养的脐静脉内皮细胞上。但NK细胞上则缺如。阵发性血红蛋白尿(paroxysmal nocturnalhemohlobulinuria,PNH)病人的红细胞上也缺少DAF,并以缺乏程度将该病分为三个型。PNH病人的红细胞对补体介导的溶血作用高度敏感,就是由于红细胞上缺乏DAF及基它含GPI锚的分子而引起的。DAF带有Cromer抗原。极少数称之为Inaba或IFC缺乏的Cromer相关抗原的个体也缺乏DAF。
DAF生物学活性及生理功能已虱到充分证实。它可保护宿主细胞免遭补体介导的溶解破坏。其作用机理是,DAF不仅可阻止经典或替代途径C3和C5转化酶的装配,并且可通过诱导催化单位C2a或Bb的快速解离而使已形成的C4、C5转化酶失去稳定性,从而抑制补体攻击单位的活化(图5-15)。DAF的这种抑制作用**于直接结合在细胞上的C3、C5转化酶,也即DAF不抑制靶细胞上正常的补体激活剂如微生物和**复合物。但DAF不能作为I因子裂解C3b和C4b的辅因子而发挥作用。另外,DAF虽不能阻止C2和B因子(分别通过与C4b或C3b结合)与细胞的*初结合,但却可使C2a或Bb由它们结合的部位解离出来,以而阻止C3转化酶的装配。
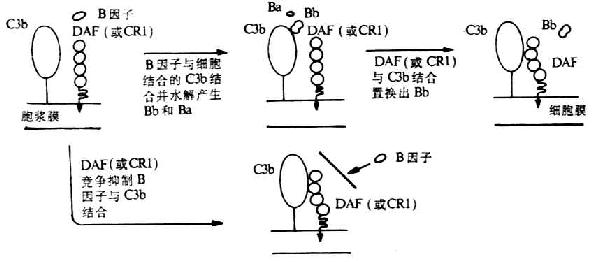
图5-15 DAF抑制替代途径中C3转化酶形成的的机理
编码人DAF的基因位于第1号染色体的长臂上32区一个800kb片段内,与其它几种补体激活调节剂(RCA)的基因紧密连锁,排列顺序依次为:MCP-CR1-CR2-DAF-C4bp。其中DAF基因的长度约为C4bp。其中DAF基因的长度约为35kb,以限制性酶谱分析表明为一单拷贝基因。在DAF基因的非编码区还有3个限制性酶切片段长度多态性(RFLP)结构,两个为HindⅢ酶切位点,1个为Bamh Ⅰ酶切位点。DAF的cDNA已克隆成功,并进行了核苷酸和氨基酸序列分析。关于DAf cDNA和膜糖蛋白的结构见图5-16。DAF的cDNA结构从5`端开始依次为:信号肽区、四个SCR(长度1143bp)、富含丝氨酸与苏氨酸(S/T)的区(约70个氨基酸)及疏水区,*后终止于3`端的poly(A)。由cDNA推导的氨基酸序列得出DAF蛋白由381个氨基酸所组成,包括34个氨基酸的信号肽,富含S/T的区为DAF中大多数延伸的O-连接的糖基化部位。SCR中有1上N-连接的的糖基化部位。C末端的疏水区在翻译后被糖磷脂所取代,为DAF分子与细胞膜相结合的部位。
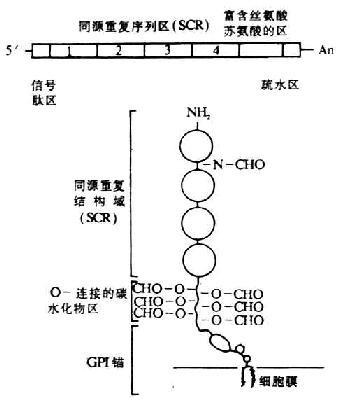
图5-16 DAF cDNA和其膜糖蛋白的结构
