1.详情
细胞迁移在许多复杂的生理和病理过程中起着重要作用。伤口**测定是研究体外细胞迁移的简单方法。该测定基于以下观察:在汇合的单层中人工产生的间隙边缘上的细胞将迁移直至建立新的细胞 - 细胞接触。ibidi Culture-Insert 2 Well为伤口**实验提供了完整的解决方案,从样品制备到图像分析只需要几个步骤。
本应用简报是使用ibidi Culture-Insert 2 Well 在24孔培养板上分析MCF-7细胞迁移实验的详细方案。并行测试了五种不同浓度的人表皮生长因子(hEGF)对迁移行为的影响并与对照条件进行比较。
2.材料
·细胞:MCF-7(ATCC:HTB-22;DSMZ: ACC115)
·ibidi实验耗材:Culture-Insert 2 Well 24, ibiTreat (ibidi, 80242)
·细胞培养表面:ibiTreat
·细胞培养基:RPMI (Sigma, R8758) + 10% FCS (Sigma, F0804)
·细胞解离溶液:Trypsin-ETDA (Sigma, 59418C)
·生长因子:human epidermal growth factor (hEGF) (Promokine, C-60170)
·无菌镊子
·倒置显微镜,*好具有自动图像采集系统和用于活细胞成像的顶部培养箱
3.实验工作流程
在该实验中测试了hEGF对MCF-7细胞迁移行为的影响。使用五种不同的hEGF浓度,并将迁移行为与未用hEGF处理的对照细胞进行比较。
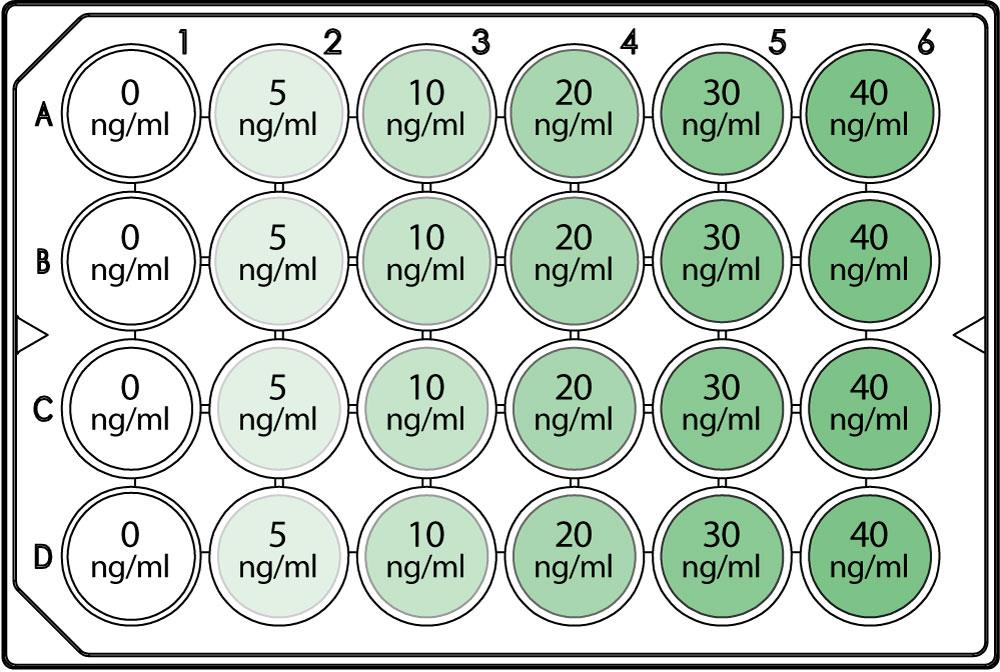
图1实验装置:测试了五种不同的hEGF浓度(绿色)(5,10,20,30,40ng / ml)。未处理的细胞(白色)作为对照。对每种条件进行四次技术重复。
3.1 步骤1:细胞接种
正确的接种浓度是一个关键参数,因为24小时后应达到汇合的单层。需要进行预实验以确定所用细胞系的*佳浓度。
1. 取下附在μ-Plate底部的保护膜(图2A)。
2. 像往常一样准备细胞悬液。建议包括离心步骤以去除死细胞和细胞碎片。将MCF-7细胞悬浮液调节至细胞浓度为5×105细胞/ml。
3. 将70μl细胞悬浮液应用于2孔的培养插件每个孔中(图2B)。避免摇动μ-Plate,因为这会导致细胞分布不均匀。
4. 将细胞在37°C和5%CO2培养至少24小时。
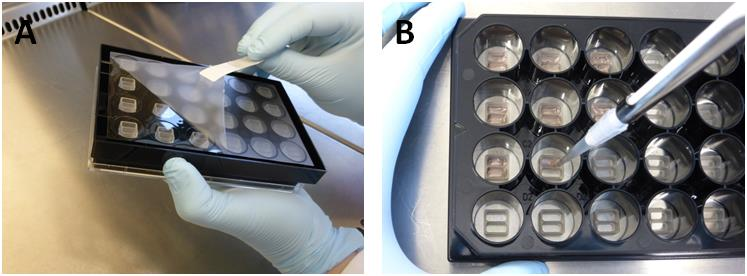
图2在开始细胞接种步骤(A)之前取下保护膜。将70μl细胞悬浮液填充到2孔培养插件(B)的每个孔中。
3.1 步骤2:划痕形成
μ-Plate 24 Well的使用并行测试五种不同的hEGF浓度和对照条件。每种实验条件可以进行四次技术重复(图1).
1. 在显微镜下观察培养24小时后的细胞密度。如果24小时后未达到融合细胞单层,则将μ-Plate于细胞培养箱中再培养几个小时。定期检查汇合点。
2. 将生长因子添加到细胞培养基中以获得以下浓度:0,5,10,20,30和40ng / ml EGF。
3. 用无菌镊子轻轻取出2孔培养插件。要移除培养插件,请抓住一个角,如图3所示。
4. 用无细胞培养基或PBS洗涤细胞层以除去细胞碎片和未附着的细胞。
5. 小心吸出无细胞培养基或PBS。
6.用移液管将1ml细胞培养基加到24孔板的每个孔中。

图3使用无菌镊子取出2孔培养插件
3.1 步骤3:获取显微镜图像
我们建议录制延时视频,以确定时间依赖性和细胞迁移的特征。
1. 将μ-Plate 24孔培养板放在显微镜上并确定所有24个孔的位置。
2. 在接下来的几个小时内多次拍摄图像,开始观察过程。在24小时内每30分钟拍摄一次图像。
4.结果
分析显微图像以获得关于培养细胞迁移特征信息。分析细胞覆盖区域随时间的变化来确定细胞速度。

图4 hEGF对MCF-7细胞迁移行为影响的比较。测试了四种不同的EGF浓度,并与对照实验进行了比较。
使用Culture-Insert 2 Well 在24孔培养板上进行测试六种不同(或更多)的条件。通过比较细胞速度与对照条件的速度来分析五种不同hEGF浓度(每种重复四次)的影响。实验数据显示,与对照组相比,hEGF增加了MCF-7细胞的细胞速度。如图4所示,hEGF> 10ng / ml的浓度显示细胞速度没有进一步增加。
