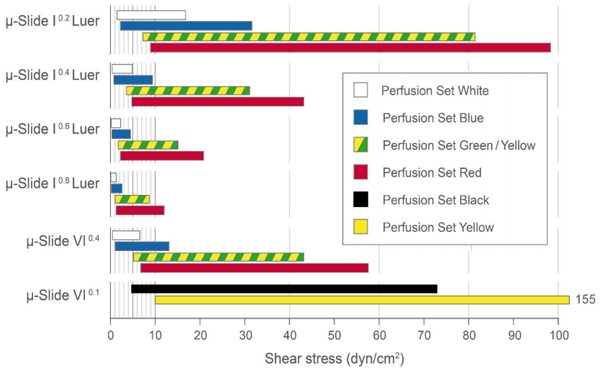
1.哪些特定应用使用µ-Slide VI 0.1?
如果实验中的细胞数量有限(例如当使用原代小鼠细胞时),或者使用*少量的试剂做进行**荧光,建议使用µ-Slide VI 0.1 。对于灌注实验,µ-Slide VI 0.1 会产生*高水平的剪切应力。
2. µ-Slide内的流型是Y型湍流吗?
不是,当使用标准流速和水性介质时,在小通道中无法真正实现湍流特性。无量纲雷诺数(Re)用于表征不同的流型。层流发生在低雷诺数,而湍流发生在高雷诺数。表明管道和生物容器中层流的临界雷诺数是Re=2000。雷诺数超过Re 4000,*有可能代表湍流。即使在 µ-Slide y-shaped中流速非常高(60毫升/分钟),雷诺数仍非常低,约为Re=200,表明层流。
3.多大的剪切应力适合于滚动和粘附分析?
在滚动和粘附分析中,应该使用与内皮细胞层的标准流动调节相同的参数。有两件事需要考虑: 首先,在进行滚动和粘附实验之前,内皮细胞层应该进行几天的流动调节。这个阶段的剪切应力可能不同于在滚动和粘附期间施加的剪切应力。其次,在粘附试验中,灌注培养基的速度也起作用。可能需要改变剪切应力。此外,有必要测试*佳流速/剪切应力。
4.为什么我的细胞在流动条件下没有拉长?
内皮细胞的生理形状在不同类型的血管中差异很大。并非所有类型的内皮细胞在其生理环境中都被拉长。
例如,HUVEC在血流的**阶段伸长。为了覆盖整个表面,细胞通过在流动方向上伸长来增加它们的表面。在此流动期之后,细胞层生长成定向鹅卵石图案,不再显示显著的伸长。
5.在进行分析之前,应该对细胞层施加多长时间的剪切应力?
细胞对机械剪切应力的适应性反应可长达数天。因此,根据您正在研究的标记,可能有必要在分析前对细胞层进行长达几天的调节。我们建议在长期实验中测试感兴趣的参数,以确定*佳的测量时间点。
6.应该对内皮细胞施加多大的剪切力?
生理剪切应力取决于感兴趣的组织和血管类型。根据文献,人体内的生理剪切应力值在0至60dyn/cm²之间变化。在开始实验之前,确定适用于所用细胞类型的相关剪切应力范围至关重要。有关剪切应力对细胞影响的更多信息,请点击查看这里(这是个链接2023-03-10发布的公众号)。
7.如何增加流动分析中的细胞数量?
将通道载玻片串联到一个灌流装置/流体单元中,可以轻松地增加流式检测中细胞的数量。应用说明书25(这是个链接2022-07-15发布的公众号)提供了连接多个通道载玻片到一个流体单元的详细方案。 此外,将细胞播种到通道底部和顶部,也可以增加通道中的细胞数量。
8.在开始流动之前,细胞应该附着多久?
在流动开始之前,细胞必须紧密附着在通道载玻片底部。附着时间取决于细胞类型、培养基添加物和表面。例如,在胶原涂层表面上使用HUVEC时,附着时间只需半小时。之后,就可以施加剪切应力。为了使细胞有机会适应新的环境条件,建议逐步增加剪切应力。关于HUVEC的详细信息请参阅应用说明13(这是个链接2022-08-24发布的公众号。
9.硅珠如何再生?
将硅胶珠加热即可轻松再生。请按照ibidi泵系统的说明书中的方案进行回收。
10.灌注装置多久可以重复使用一次?
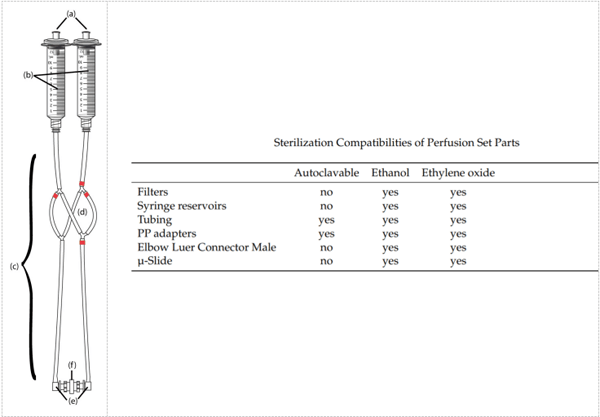
我们不建议重复使用灌注组件。每次实验都使用一个新的灌注装置,可获得*可复制和*可靠的结果。您可以在ibidi泵系统说明书中找到有关**和清洁的其他信息。
11.如何确保细胞获得孵化后的空气?

ibidi泵系统的设置确保来自培养箱内部的具有正确CO2浓度的无菌空气驱动灌注。有关详细说明,请参见ibidi泵系统的说明书。
12.如何计算通道载玻片中悬浮细胞的剪切应力?
在通道中通过液体时,壁面摩擦会导致流动速度呈抛物线形。通道中心的流速将比壁面快。剪切应力仅在通道或管道的壁面上发生。因此,只有附着在通道壁/底部的细胞才会经历剪切应力。通道中央的悬浮细胞将经历不同的流速,与靠近通道壁的细胞不同。因此,对于悬浮细胞,剪切速率是需要考虑的相关因素,而不是剪切应力。
