在肿瘤**学领域,单细胞技术可以帮助科学家们更好地了解肿瘤细胞的生长和扩散机制,以及**系统如何识别和攻击肿瘤细胞。然而,组织样本单细胞悬液制备是单细胞测序实验中至关重要的工作,其质量好坏直接影响了后续建库的成败以及测序数据产出质量。因此,单细胞悬液制备除了需要有经验丰富的人员来进行指导/操作,还得依靠靠谱的单细胞悬液制备仪来助力。
一、实验设备

单细胞悬液制备仪
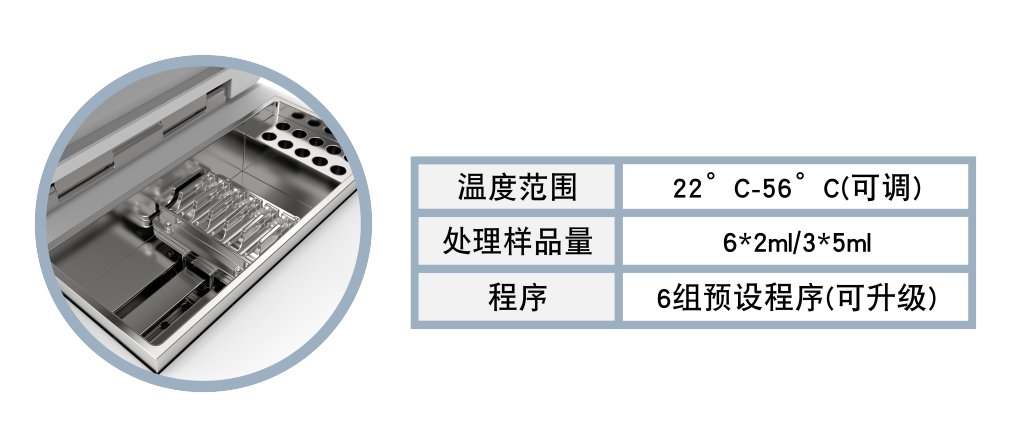
JX-CKSM-6WK
应用领域:肿瘤研究、心血管研究、干细胞研究、**研究、神经科学研究
二、实验过程
01 组织获取、清洗
1.荷瘤鼠麻醉后处死,取肿瘤组织200-500 mg,迅速置于装有4 ℃不含血清的培养液或PBS的无菌培养皿中,将培养皿放置冰上快速拿回实验室。(一小时内分离肿瘤细胞)。
2.上述组织使用含有1 %双抗的PBS洗涤三次,眼科剪去除组织块中的脂肪、坏死组织等无用组织。
02 酶消化、机械分离
1.用剪刀将组织切割成1-2 mm³左右的小块,用4℃ D-Hank's液洗1次,尽量去除剪碎组织过程中产生的组织碎片。
2.样品管内加入200-500 mg组织及消化酶,放入单细胞悬液仪,选择内置程序运行。
3.消化完成后,适当震荡样品管,观察浑浊度与颜色,并用细胞筛过滤出单细胞悬液,随后加入消化终止液,*终得到细胞悬液。
03 洗涤和重悬(选择性去红)
1.如有大量红细胞污染,加入红细胞裂解液(自备)裂红,230-250 g离心后加入PBS重悬,随即230-250 g离心洗涤并培养基重悬。
2.结果:单细胞悬液应当保持95 %以上活率(PI染色流式或台盼蓝染色镜检),总数目在3×107左右。
操作流程图

三、样品前后对比
样品研磨前效果图
样品研磨后效果图
实验解决的问题
从组织获得存活单细胞是一个复杂过程,处理当中常存在处理时间长、细胞处于逆境状态时间长、细胞得率低、细胞存活率低、操作繁琐等问题。使用JX-CKSM-WK系列单细胞悬液制备仪,具有起始组织量小,时间短,细胞得率高,细胞活性高的特点。常应用于流式细胞术/单细胞测序/原代细胞培养等实验。
