随着Kite
Pharma公司宣布,已向欧洲药监局(EMA)提交使用其CAR-T细胞产品(axicabtagene
ciloleucel,KTE-C19)的营销授权申请(MAA);诺华的CAR-T疗法CTL019(tisagenlecleucel-T)以10:0的投票结果获得咨询委员会专家全票推荐。在历经数十年的曲折研究中,CAR-T细胞疗法也迎来了阶段性的胜利。
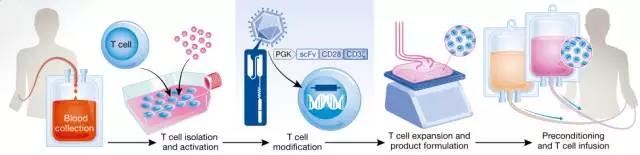
CAR-T细胞**(图片来源 EMBO)
已完成和正在进行的CAR-T细胞临床试验
截至2016年底,已记录了220项CAR-T细胞试验,其中188项正在进行的临床试验中包括9项长期随访研究。进行的大多数临床试验主要是评估**性和剂量标准的Phase
1(128),但是Phase 1/2和Phase
2的临床试验的疗效评估正在逐渐赶上,特别是以CD19为靶点的CAR-T细胞疗法进展*快(phase 1/2 or phase 2
试验中的75项包括39项)
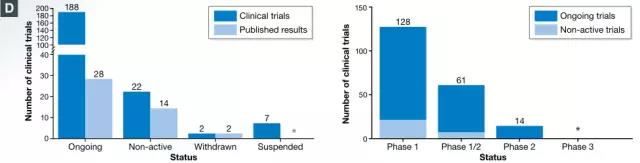
在ClinicalTrials.gov注册的已发表的CAR-T细胞**的试验状态,包括长期随访研究(图片来源 EMBO)
在**代CAR-T细胞试验中,研究人员通过靶向叶酸受体或碳酸酐酶IX(CAIX)**晚期上皮性卵巢癌或转移性肾细胞癌患者(Kershaw等,
2006; Lamers等,
2006)。接下来的两项登记在册的临床试验,公布的结果报告了1例神经母细胞瘤和1例滤泡**瘤患者获得了完全缓解(Park等, 2007;
Till等, 2008)。
近几年,随着CD19特异性CAR-T细胞**B细胞恶性肿瘤的重大突破,临床研究结果表明缓解不再是针对于个体,而是绝大多数患者。基于有希望的结果,CAR-T细胞疗法的临床试验数量就开始了大幅增加,几乎呈指数增长。仅在2016年,就有62项新的CAR-T细胞临床试验在ClinicalTrials.gov上注册。
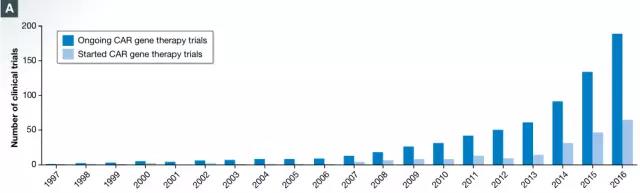
CAR-T细胞试验的时间表(图片来源 EMBO)
CAR-T细胞疗法*初起源于美国,然后传播到世界其他地方。目前,有89个CAR-T细胞临床试验正在美国以外进行,其中在中国进行的临床试验*多(66项),而欧洲有14项(其中8项在英国进行、3项在德国、3项在法国)。与美国和中国相比,欧洲显然是落后的一方。
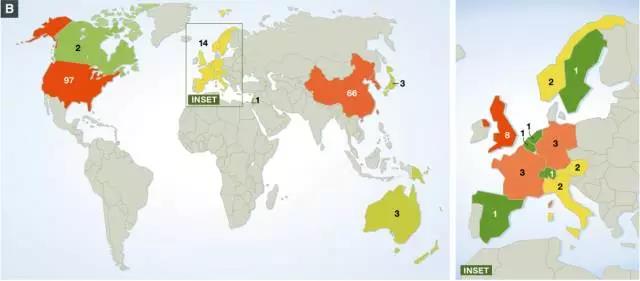
全球正在进行的CAR-T细胞临床试验的地理分布(图片来源 EMBO )
目前的试验中,包括针对血液恶性肿瘤的有133项和针对实体瘤的78项。对于造血和**系统的肿瘤,正在研究的有17种不同的CAR抗原。其中*常用的抗原是CD19(正在新型的临床试验有56项,8项稳定性试验),针对实体瘤的研究则以靶向CD22抗原为主。而以前的研究集中在以CEA作为靶向抗原**结肠直肠癌、乳腺癌、胃癌、腺癌以及继发性肝癌。目前正在进行的试验的靶点还包括间皮素、ErbB2 / Her2、GD2(神经母细胞瘤或肉瘤)或GPC3(肝细胞癌)。
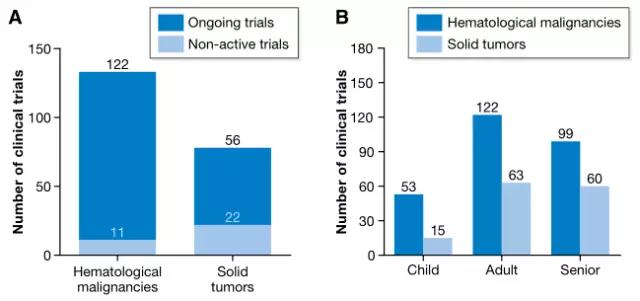
血液恶性肿瘤和实体瘤的临床试验数量(图片来源 EMBO)
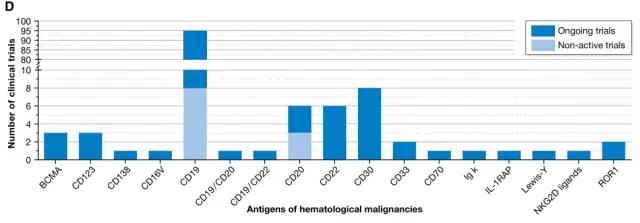
血液恶性肿瘤的17种靶向抗原(图片来源 EMBO)
大多数临床试验使用的是自体细胞疗法,unselected
PBMC(外周血单核细胞)作为起始物质,在经典刺激因子IL-2下产生具有活化的效应T细胞表型的CD4和CD8
T细胞组成的CAR-T细胞产物。近年来,已开发出分离定义的T细胞子集或将T细胞转化为一定表型的方法(Xu等, 2014; Ramos等,
2016; Turtle等, 2016)。
此外,自动化制造可能是其简化过程并增强CAR-T细胞生产的一个选择,使用自动化GMP细胞处理系统生成的CD19-CAR-T细胞已经被证明其转导效率、表型、疗效和总体产量可以与传统工艺所产生的CD19-CAR-T细胞相比较(Mock等, 2016;Priesner等, 2016)。
一般情况下,CAR-T细胞是通过静脉注射的。但也有研究尝试了其他给**式:肿瘤内(You等,
2016,颅内(Brown等, 2015)或腹膜内注射(Koneru等, 2015)、肝动脉(Katz等,
2015),胸腔内灌注(Petrausch等,
2012)。为了增加**的耐受性和降低副作用的风险,给定的CAR-T细胞剂量通常分为多次注射(例如,1天分3次注射)。
值得注意的是,注入细胞的总数取决于产品内的CAR阳性T细胞的百分比,而且在不同的研究之间和单独的试验中都是高度可变的。
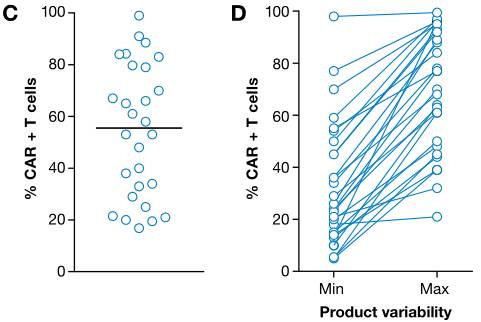
CAR-T细胞产物中CAR阳性细胞的百分比(图片来源 EMBO)
对于四代CAR-T细胞,可以观察到使用直接伴随有慢病毒载体(LVs)的γ-逆转录病毒载体(RV)的轻微偏好。只有很少的临床研究使用电穿孔技术来转移CAR构建体,在大多数试验中,**代CAR已经被转化到了临床应用上,靶向CD19的第三代或第四代的CAR正在测试。

四代CAR-T细胞疗法的临床试验数目(图片来源 EMBO)
CAR-T疗法对于癌症患者的临床效益
受益于CAR-T细胞疗法的患者*有名的病例可能就是Emily Whitehead了,作为一名患有复发性急性**细胞性白血病(ALL)的儿童,现在的Emily已经健康的生存了5年了(http://emilywhitehead.com)。NCT01626495,正是Emily所参与的的临床试验。
对于B细胞恶性肿瘤,CAR-T细胞疗法似乎特别有效。究其原因是因为CD19或CD20的肿瘤细胞选择性和均一性表达,以及CAR-T细胞很容易对其进行识别。
在一项CD19 CAR-T细胞疗法的临床试验中,接受**的243名患者(199名**,44名儿童)中,客观应答率超过60%,而且只有20%的患者没有应答。值得注意的是,在包括儿童和**患者在内的试验中,临床结果似乎与年龄无关(Cruz等, 2013; Maude等, 2014; Lee等, 2015; Zhang等, 2016)。
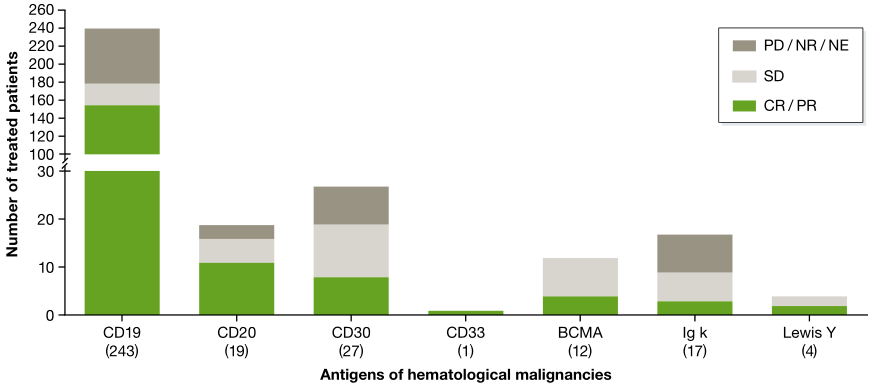
CAR-T**血液肿瘤的临床结果,**患者的数量位于靶抗原下方的括号中(图片来源 EMBO)
在编号为NCT00968760、NCT01865617、NCT01815749、NCT01626495、NCT01044069的五项临床试验中,超过85%的患者达到了*佳临床结果-完全缓解(CR)。在这些试验中,评估的时间点范围为4周(Turtle等, 2016)至30个月(Kebriaei等, 2016)。
入组患者包括在骨髓(BM)中、髓外部位或脑脊液中存在不同等级的可检测的**—急性**细胞白血病(ALL)或非霍奇金**瘤(NHL)。还包括了由BM中的母细胞百分比定义的*小残留病(MRD)或形态学**患者。
有趣的是,形态学**患者和MRD患者的缓解率似乎没有明显差异(Davila等, 2014; Maude等, 2014; Turtle等, 2016; Park等, 2017)。但是在经过18个月的随访后,MRD的患者的寿命明显更长(Park等, 2017)。因此,低水平的肿瘤负担似乎提高了CAR T细胞**的耐久性,至少在**ALL的试验中是这样的。
所以在CAR-T细胞**前,通过化疗降低肿瘤负担是可行的。而且在接受CAR-T细胞**后,获得完全缓解的患者可以接受同种异体造血干细胞移植(HSCT)的**,以提供额外的**潜力。
在针对急淋(ALL)的研究中,CAR-T细胞诱导的缓解已经通过移植进行了不同程度的巩固[n=3/30,
11%; (Maude等, 2014); n=7/14, 50% (Davila等, 2014); n=10/14, 71% (Lee等,
2015); n=13/ 27, 48% (Turtle等,
2016)]。尽管存在一些差异和短期随访的局限性,但研究之间的应答持久性似乎非常相似。这表明无论患者是否接受HSCT**,CAR-T细胞疗法都可能提供显著的临床疗效。
此外,在相同的研究中经常被忽视的是,大部分患者在接受CAR-T细胞**之前进行过移植**,而这表明了对移植物抗白血病效应不敏感的肿瘤对工程化CAR-T细胞而言是敏感的。

James N. Kochenderfer,MD(图片来源 ccr.cancer.gov)
总体而言,CD19 CAR-T细胞疗法对急淋(ALL)患者*有效,在之后是非霍奇金氏**瘤(NHL)以及慢性**细胞白血病(CLL),这也表明了CAR-T细胞疗法在不同的癌症类型中发挥的作用是不同的。
另外,CAR-T**NHL的初步临床结果也是很令人激动的,在九个**别的化疗耐药性的NHL病例中,四例患者达到完全缓解,另外两例部分缓解(Kochenderfer等,
2015)。由Kite Pharma与同一CAR
T细胞产品赞助的随后试验的初步结果证实了这些结果,七个患者中有四个**达到完全缓解,持续12个月(Locke等,2017)。
而一般**别的化疗耐药性NHL的预后都比较差,中位生存期仅为几周,因此这项临床结果也促使Kite Pharma向FDA提交CAR-T细胞产品(KTE-C19)的上市申请。相比较CD19,靶向血液恶性肿瘤的其他肿瘤抗原的临床疗效倒是不太明显,尽管大多数正在进行的试验还未到达终点。
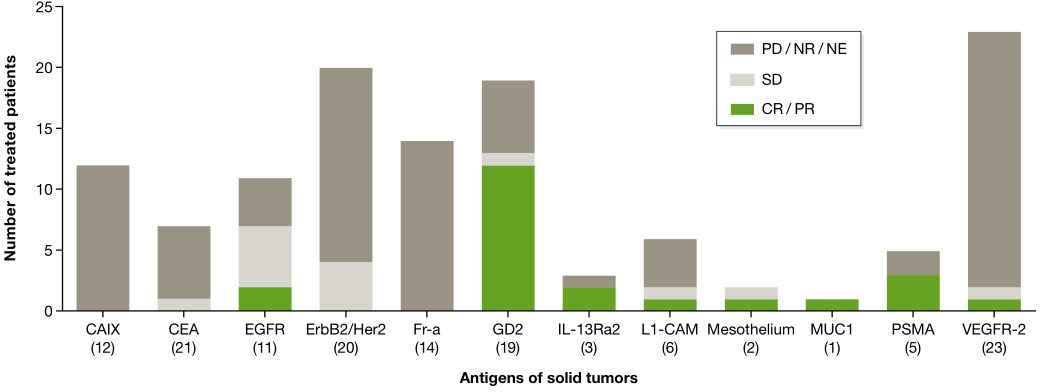
CAR-T**实体瘤的临床结果,**患者的数量位于靶抗原下方的括号中(图片来源 EMBO)
与血液病恶性肿瘤得到的结果不一致的是,CAR-T**实体肿瘤(12种不同抗原靶点)就没有那么顺利了,但是在一项针对神经母细胞瘤患者的I期临床试验中,以GD2为靶点的CAR-T细胞疗法使患者的完全缓解率(CR)超过了50%。(Louis等,2011)。
结语

近日,Kite
Pharma宣布,已向欧洲药监局(EMA)提交使用axicabtagene
ciloleucel(KTE-C19)**顽固性弥漫性大B细胞**瘤(DLBCL),转化滤泡**瘤(TFL),和原发性纵隔B细胞**瘤(PMBCL)的营销授权申请(MAA),用于不适用自体干细胞移植的癌症患者。此项申请是**个向EMA提出的嵌合抗原受体T细胞(CAR-T)疗法。而诺华的CAR-T疗法CTL019(tisagenlecleucel-T)也以10:0的投票结果获得咨询委员会专家全票推荐。
美国和欧洲市场也将迎来**批CAR-T细胞产品。然而,由于CAR的特异性设计、递送、调节和基因组编辑以插入CAR基因的无限选择,我们可以很容易想到,将来会有更多的基于CAR-T细胞的产品进入临床研究,而这也会增加**实体瘤的选择以及简化CAR-T细胞生产过程。
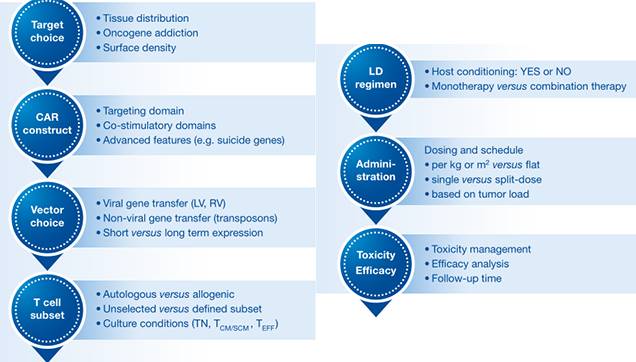
CAR-T细胞试验中的重要驱动因素(图片来源 EMBO)
研究人员则需要从迄今为止完成的试验中尽可能多地获得信息将有助于这些新举措,尽管CAR-T细胞**(CAR构建,制造过程,指征和临床试验设计)太过于复杂,对于不同试验结果的详细比较似乎是不可能的,但是对于所有类型的CAR-T细胞疗法常见的一些重要因素是可以临床资料中得出结论的。
*后必须强调的是,制定毒性管理计划并确定生物标志物以预测常见的毒性也是相当重要的,因为*终的总体生存数据将允许对CAR-T细胞疗法的长期效益风险结果进行真正的比较。
参考出处:
DOI 10.15252/emmm.201607485
http://www.kitepharma.com/
https://www.adn.com/nation-world/2017/07/12/first-gene-therapy-a-true-living-drug-on-the-cusp-of-fda-approval/