Nandini Prabhakar*, MarcusWolschek+ , Micaela Goh Yue Lyn*, Manfred Reiter+ , Joachim Seipelt+, Xiangliang Lin*
*Esco Aster Pte Ltd, Singapore
+Nuvonis Technologies GmbH, Austria
前 言


每年接种疫苗是预防流感的有效方法。然而,满足发展中国家对流感疫苗的需求面临许多挑战。非疫苗生产国需要及时部署和生产流感疫苗。我们专注于流感疫苗的快速发展,以提供一种可以替代用鸡蛋生产疫苗的完//美生物加工解决方案为目标,帮助加快生产过程。
Esco Aster专注于高质量的疫苗、生物制品和细胞**产品的生产。为了帮助非疫苗生产国在疫苗的生产、储存和分配方面实现自给自足,我们近期与Nuvonis生物技术公司(奥地利)合作,建立了高效的生物处理流程。它使用Nuvonis无血清Vero细胞库高效生产流感病毒。我们证明,TideXcell与Esco细胞处理隔离器模块集成化,有助于疫苗生产的本地化,使其在资本支出和运营成本方面更适合发展中国家。
Vero细胞
Vero细胞是一种贴壁依赖细胞,广泛应用于疫苗生产。它们源自非洲绿猴的上皮肾细胞。它们在病毒高感染性方面具有许多优势,因此对于原代病毒分离非常有效。Vero细胞易被多种病毒感染,例如流感、狂犬病、呼肠孤病毒和日本脑炎病毒。与传统2D的T方瓶和滚瓶相比,需要将Vero细胞培养到更高的密度。我们使用3D片状载体BioNOC在500ml CelCradle培养瓶中将Vero细胞培养至适宜密度。
潮汐式生物反应器培养Vero细胞
无血清Vero细胞研究细胞库(144-160代)可用于所有应用。细胞库(包括MCB和WCB)已得到充分表征,包括在生产结束时进行致瘤性测试(EOP)。使用前,在无血清培养基中补充L-谷氨酰胺。有血清的培养基也用于细胞生长试验中以进行优化。使用Esco GlucCell™葡萄糖检测仪和测试片测量培养基中的葡萄糖。
Vero细胞生长动力学如图1 (a)和(b)所示,葡萄糖消耗见(c)和(d)。
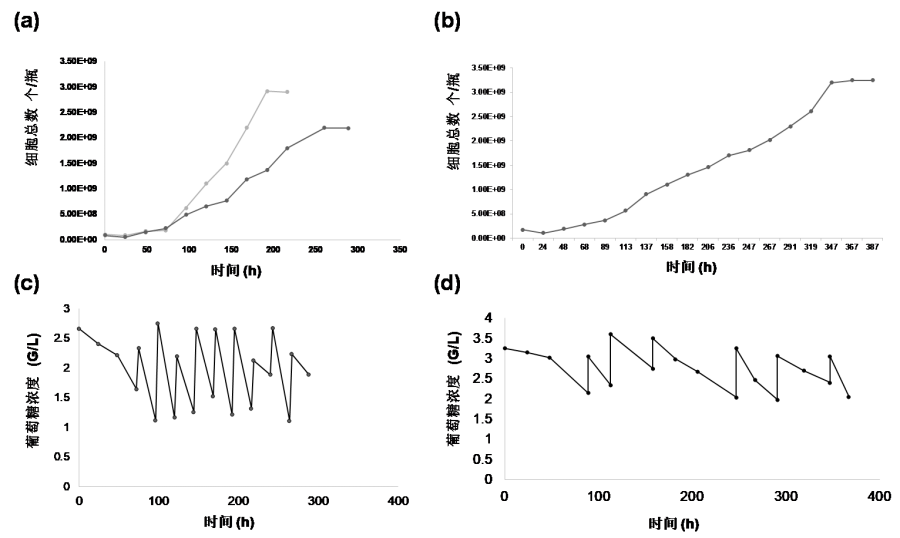
图 1 Vero (a)无血清培养基和(b)有血清培养基培养的细胞生长曲线以及相应培养液中的葡萄糖浓度情况(c)和(d) 。M:更换培养基;HM:更换一半培养基;Gl:添加葡萄糖

图 2 (a)BioNOC片状载体支持Vero细胞生长,为细胞生长提供了较大的表面积。(b)显微镜4倍放大的BioNOC片状载体和(c)Vero细胞。用荧光素二乙酸酯(FDA)和Hoechst对细胞进行染色,(d)代表早期培养,(e)代表晚期培养。
培养的Vero细胞用于流感疫苗生产
用胰蛋白酶消化收获5个T-175方瓶内细胞,275 g离心5分钟弃上清,将细胞重悬于细胞生长培养基中。将细胞悬液与细胞生长培养基以总体积500 ml混合后,转移至CelCradle-500AP(灌流),并使用下面的潮汐运动参数进行细胞培养。培养1小时45分钟后,取部分培养基,使用台盼蓝染色对细胞计数。85%的细胞稳定地附着在载体上。细胞生长的潮汐参数如下:

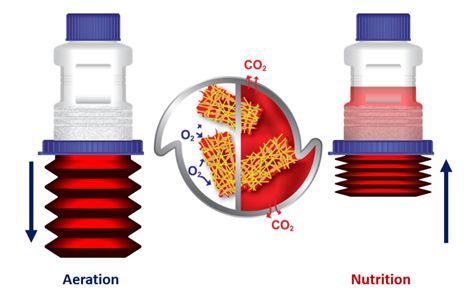
病毒感染方法
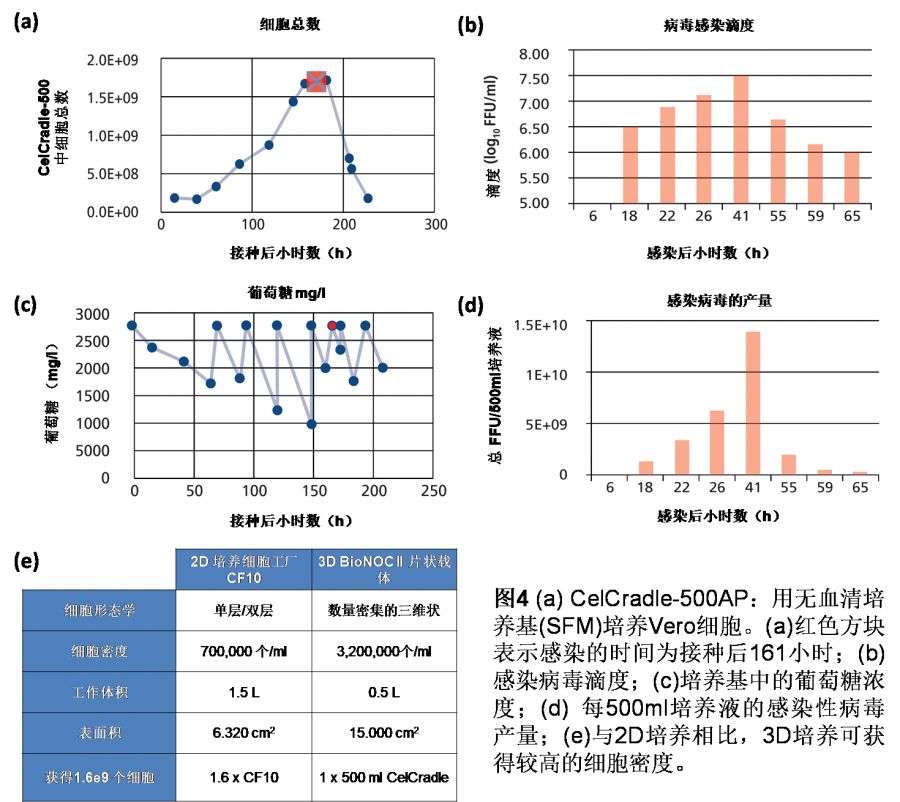
在无血清条件下,培养Vero细胞167小时(7天)后,总细胞数为1.7e9。Vero细胞感染A型流感病毒株的感染复数(MOI)为0.01。病毒感染后,更换培养基7次。采用荧光聚焦法(FFA)测定各培养基中感染病毒的滴度。共检出感染性病毒10.45e10 FFU/培养瓶。示意图如图3所示,结果如图4(a-e)所示。
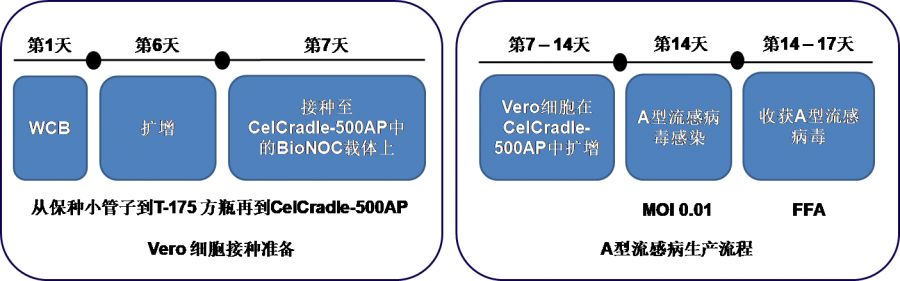
图 3 使用CelCradle-500AP进行Vero细胞种子培养准备和A型流感病毒生产过程。工作细胞库(WCB);感染复数(MOI);荧光聚焦分析(FFA)。
病毒产量
结 论
在此研究中,已证明可以使用无血清培养基将Vero细胞培养到2.9e9(5e6 cells / ml)的高密度培养,使用含血清的培养基将其培养到3.3e9(6e6 cells / ml)的高密度培养。这代表了一种高效的生物工艺流程,可以使用潮汐运动平台和细胞处理隔离器扩大规模以应用于疫苗生产。
展 望
这些实验成果可以在cGMP设施中进一步优化,扩大规模以批量生产流感疫苗。

致 谢
在此特别感谢位于奥地利维也纳的生物技术公司Nuvonis Technologies GmbH,该公司生产具有完整特征的GMP Vero细胞系和流感病毒株。
