水分在物质表面的吸附作用是可逆的。与物质表面直接结合的单分子层*紧密,不容易被微生物利用。当物体表面形成多层水分子结构,外层的吸附水自由度较大,较易重新解析为自由水,可直接被微生物利用。水分活度(aw)即物质中的自由水。水活度的范围从纯净水的1.00至极干物质的0.00,能影响微生物的生长。如果水活度低于微生物的*低需求,微生物生长的迟缓期会延长,对数期缩短,稳定期的微生物总数下降直到不再生长。
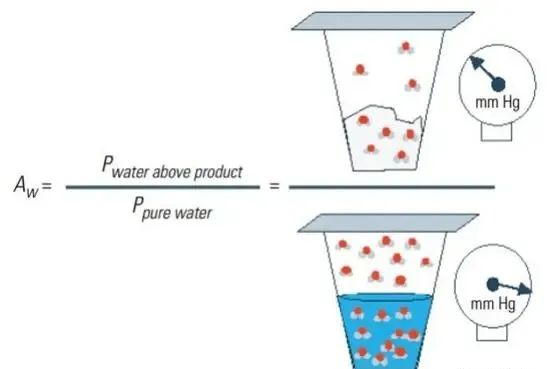
各种微生物对aw的生长需求不同。一般**所需*低aw较高,除常见的金黄色葡萄球菌(需氧)为0.87外,大多数**所需*低aw>0.90。霉菌所需*低aw在0.75~0.85。这意味着,如果产品的aw在0.90以上,就有被**、霉菌和酵母污染的风险。如果aw在0.77~0.90,产品受霉菌和酵母的污染概率更大。如果aw在0.77以下,产品受微生物污染的风险变小,可以减少常规的微生物检测。药品aw检测对于预测产品的潜在污染微生物类型、保持化学稳定性、评估物理性质至关重要。通过控制药品aw可以降低微生物污染的风险,还可以用于为不同剂型药品设置更加科学合理的微生物标准。美国药典USP<1112>将aw应用于非无菌药品的监测上,日本药局方(JP17)也利用aw值设置不同非无菌制剂的微生物限度标准。

美国药典不同药品aw应用中,分别对鼻吸入剂、头部外用洗剂、解酸剂及口服液等制剂进行分析,根据制剂aw情况,推测出其潜在微生物污染,从而推荐检测项目。我国*新出版的《中华人民共和国药典》2020年版未涉及aw。
仪器与试药

阿莫西林胶囊、穿王**胶囊、诺氟沙星胶囊、头孢氨苄胶囊、头孢拉定胶囊、女金胶囊、宫炎平胶囊、金水宝胶囊、盐酸雷尼替丁胶囊、蚓激酶肠溶胶囊、裸花紫珠胶囊各10批。
aw测定方法
打开水活度仪,等待质检通过。用标准液校准仪器后,将样品置于aw测量杯内,将测量杯置于仪器中,点击“开始”后,仪器自动进行检测,记录仪器显示的检测值,每一个样品平行检测3次,计算平均值,得到该样品aw值。
微生物检测
按照《中华人民共和国药典》2015版四部非无菌产品微生物限度检查:微生物计数法(通则1105)、控制菌检查法(通则1106)对部分样品进行检测。具体样品信息见表1。

aw测定结果
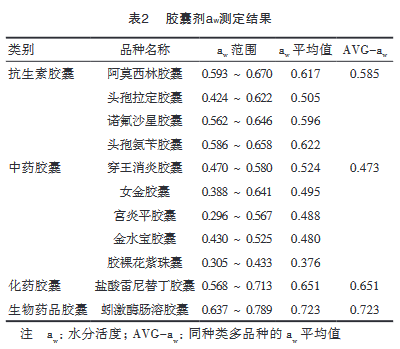
对11个品种的110批胶囊剂的aw检测结果见图1。胶囊剂aw分布于0.296~0.789,aw分布于0.300~0.400、0.401~0.500、0.501~0.600、0.601~0.700、0.701~0.800的样品数分别占总量的6.25%、27.68%、27.68%、28.57%和8.93%。

根据胶囊剂成分,可将样品分为四类:第Ⅰ类为***胶囊,样品涉及4个品种,每品种10批共40批,检测其aw分布于0.424~0.670;第Ⅱ类为中药胶囊,样品涵盖5个品种共50批,aw分布于0.296~0.641;第Ⅲ、Ⅳ类分别为化药胶囊和生物药品胶囊,各1个品种,每品种10批,aw分布于0.568~0.713、0.637~0.789。见表2。
微生物限度检测结果
对5个品种共44批胶囊剂进行微生物限度检验,检验指标为需氧菌总数(TAMC)、霉菌和酵母菌总数(TYMC)和大肠埃希菌。其中,大肠埃希菌均未检出,TAMC、TYMC结果见表3。
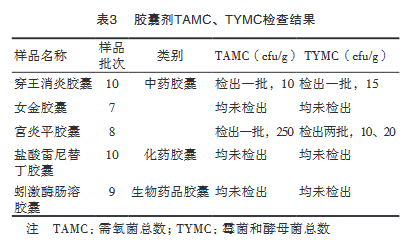
44批样品中,共检出TAMC2批,检出率为4.5%,检出TYMC3批,检出率为6.8%。检出样品的aw数据见表4。

3批样品均属于中药胶囊,检出的TAMC、TYMC均小于《中华人民共和国药典》2015年版四部1107限度标准。aw范围为0.467~0.570,低于绝大多数微生物生长所需aw,受微生物污染的风险很小。可以知道,产品中的微生物可能是原辅料携带于制剂中,或生产环境中产生的微生物污染。
讨论
通过检测分析获得了11种胶囊制剂的aw分布现状,为“水分活度测定在非无菌制剂中的应用”提供了数据支持。110批胶囊剂aw范围为0.296~0.789,与美国药典USP标准中同类制剂药品a(w0.30)数值存在一定的差异,可能与原辅料、生产工艺及产品包装不同有关。胶囊剂系指将**与辅料充填于硬质空心胶囊或密封于具有弹性的软质囊材中制成的固体制剂,本研究的样品均为硬胶囊制剂。胶囊剂在制备过程中需要对**进行干燥处理,以减少水分,因此胶囊剂aw较低。此外,**辅料可加入蔗糖、乳糖、硬脂酸镁、滑石粉等,部分辅料能降低制剂的aw。

硬胶囊剂aw均低于0.79,其中仅有2批蚓激酶肠溶胶囊(生物制剂)的aw略高于0.75(分别为0.789、0.783),其余样品aw均在0.75以下。各类胶囊剂aw均高于USP收载,药品制剂aw受原辅料、生产工艺的影响较大,aw的普遍偏高反映当前国内制药工业对aw的研究不足,在利用aw对药品进行质量控制尚有待开发。
中药胶囊平均aw<***胶囊平均aw<化学药品胶囊平均aw<生物药品胶囊平均aw。由于微生物生长所需的*低aw不同,结合美国药典根据药品制剂的aw制定微生物控制策略,建议药品制剂aw≥0.90,进行TAMC、TYMC以及该剂型规定的控制菌和其他具有潜在危害的微生物测试;0.90>aw≥0.85,进行TAMC、TYMC和金黄色葡萄球菌测试;0.85>aw≥0.60,进行TAMC、TYMC测试;药品制剂aw<0.60,可结合风险评估,逐步研究减少测试的控制方案。目前在《中华人民共和国药典》2020年版中,要求“以动物、植物、矿物质来源的非单体成分制成的胶囊剂,生物制品胶囊剂”需要进行微生物限度检查。
